جميع الأكتنيدات عناصر لينة صح ام خطا
جميع الأكتنيدات عناصر لينة لأن الأكتينيدات لها نصف قطر ذري كبير، مما يجعلها ضعيفة نسبيًا. بالإضافة إلى ذلك، فإن الأكتينيدات لها طاقة ربط ذرية منخفضة، مما يعني أنه من السهل فصل إلكتروناتها الخارجية. وفي السطور التالية نوضح كافة التفاصيل على موقع بسيط دوت كوم.
جدول المحتويات
- جميع الأكتنيدات عناصر لينة
- ما هي العناصر اللينة؟
- تطبيقات جميع الأكتنيدات عناصر لينة
- هل جميع الأكتنيدات عناصر لينة؟
- سبب جميع الأكتنيدات عناصر لينة
- ما هي الاكتينيدات؟
- تشكيل عناصر الاكتينيدات
- ما هي الخصائص الفيزيائية للأكتينيدات؟
- ما هي استخدامات الاكتينيدات؟
- هل جميع الأكتنيدات عناصر لينة؟
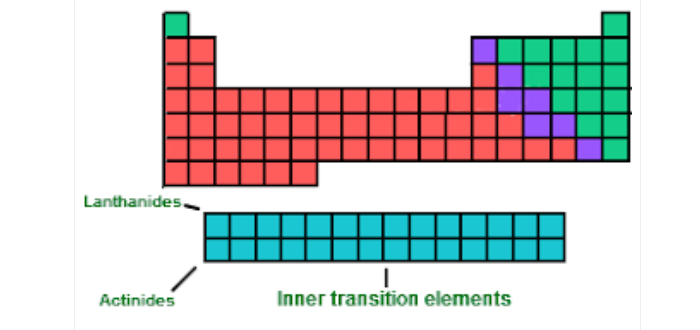
- الأكتنيدات
- اللانثانيدات
- العناصر الانتقالية الداخلية
- الفلزات
- هل جميع الاكتنيدات عناصر مشعه؟
- حل جميع الأكتنيدات عناصر لينة صواب خطأ
جميع الأكتنيدات عناصر لينة
الأكتينيدات هي عناصر نشطة كيميائيًا، وتميل إلى فقد إلكتروناتها الخارجية بسهولة. هذا يجعلها عرضة للتآكل، مما يجعلها تبدو ناعمة عند لمسها.
ومع ذلك، هناك بعض الأكتينيدات التي لها نقاط انصهار عالية نسبيًا، مما يجعلها أكثر صلابة. على سبيل المثال، يمتلك الثوريوم (نقطة انصهار 1405 درجة مئوية) وسيبوريوم (نقطة انصهار 1535 درجة مئوية) نصف قطر ذري أصغر من اللانثانيدات المقابلة لهم، مما يجعلها أكثر صلابة. بشكل عام، يمكن القول أن جميع الأكتينيدات عناصر لينة، ولكن هناك بعض الاستثناءات.
ما هي العناصر اللينة؟
العناصر اللينة هي العناصر التي لها صلابة منخفضة نسبيًا، ويمكن تشكيلها بسهولة عن طريق الضغط أو السحب. تُعزى هذه النعومة إلى بنية الذرة للعنصر، حيث تكون الذرات قريبة من بعضها البعض، مما يسهل تشويه الشبكة البلورية. وتشمل الأمثلة الشائعة للعناصر اللينة:
- المعادن القلوية: الصوديوم، البوتاسيوم، الليثيوم، الروبيديوم، السيزيوم
- المعادن الأرضية القلوية: اللانثانوم، السيريوم، براسيوديميوم، النيوديميوم، بروميثيوم
- ثم المعادن النبيلة: الذهب، الفضة، الزنك، القصدير، الرصاص
- ثم المعادن غير الفلزية: الزئبق، الثاليوم
بالإضافة إلى العناصر المذكورة أعلاه، هناك العديد من العناصر الأخرى التي يمكن أن تكون ناعمة في درجات حرارة معينة. على سبيل المثال، يكون الحديد ناعمًا عند درجات حرارة منخفضة، بينما يكون الألمنيوم ناعمًا عند درجات حرارة عالية.
تطبيقات جميع الأكتنيدات عناصر لينة
فيما يلي بعض التطبيقات العملية للعناصر اللينة:
- تستخدم المعادن القلوية في صناعة البطاريات، حيث يمكن ضغطها بسهولة إلى شكل محدد.
- تستخدم المعادن الأرضية القلوية في صناعة العدسات، حيث يمكن تشكيلها بسهولة إلى أشكال دقيقة.
- ثم تستخدم المعادن النبيلة في صناعة المجوهرات، حيث يمكن تشكيلها بسهولة إلى أشكال جذابة.
- ثم يستخدم الزئبق في صناعة موازين الحرارة، حيث يمكنه تمرير الحرارة بسهولة.
تجدر الإشارة إلى أن النعومة ليست خاصية ثابتة للعنصر. يمكن أن تتغير نعومة العنصر اعتمادًا على درجة الحرارة والضغط والظروف البيئية الأخرى.
هل جميع الأكتنيدات عناصر لينة؟
نعم جميع الاكتنيدات عناصر لينة حيث أن الأكتينيدات هي السلسلة الثانية من عناصر الكتلة f ذات التكوين الإلكتروني الطرفي 5f1-14 6d 0-17s2 طاقة الإلكترونات 5f و 6d قريبة من بعضها البعض. وبالتالي تدخل الإلكترونات في المدار 5f ، ويتناقص الحجم الذري / نصف القطر الأيوني لأيونات الأكتينيدات الموجبة الثلاثية بشكل مطرد من Th إلى Lw بسبب زيادة الشحنة النووية والإلكترونات التي تدخل المدار الداخلي (n-2) f.
هذا الانخفاض التدريجي في الحجم مع زيادة العدد الذري يسمى انكماش الأكتينيد مثل انكماش اللانثانيد، بسبب التدريع السيئ للغاية بواسطة 5f إلكترونات ، يكون الانكماش أكبر على طول الفترة.
سبب جميع الأكتنيدات عناصر لينة
تحتوي الأكتينيدات مثل أيونات اللانثانيدات على إلكترونات في المدار f وكذلك مدارات فارغة مثل عناصر كتلة d. عندما يتم امتصاص تردد من الضوء. ينتج عن انتقال الإلكترون f f لونًا مرئيًا، وتحتوي الأكتينيدات على محتوى حراري تأين أقل من اللانثانيدات لأن الإلكترونات 5f تكون محمية بشكل أكثر فعالية من الشحنة النووية مقارنة بـ 4f.
وتظهر الأكتينيدات حالات أكسدة متغيرة بسبب فجوة الطاقة الأصغر بين مدارات 5f و 6 d و 7 s. على الرغم من أن 3+ هي حالة الأكسدة الأكثر استقرارًا. إلا أن حالات الأكسدة الأخرى ممكنة بسبب الحماية الجيدة للإلكترونات f. وتزداد حالة الأكسدة القصوى أولاً حتى منتصف السلسلة ثم تنخفض، أي تزداد من +4 لـ Th إلى +5 و +6 و +7 لـ Pa و V و Np ولكنها تنخفض في العناصر التالية.
ما هي الاكتينيدات؟
يصف جميع الأكتنيدات عناصر لينة تعريف الأكتينيدات مجموعة من العناصر الكيميائية التي تتميز بطبيعتها المشعة، ونواتها قادرة على التحلل والتفتت إلى جزيئات أصغر. فالأكتينيدات هي العناصر الخمسة عشر الموجودة في الصف الثاني أسفل الجسم الرئيسي للجدول الدوري، الفترة السابعة التي تحتوي على الأكتينيدات يكون لونها وردي غامق.
كما أن الأكتينيدات هي عناصر معدنية تبدأ أعدادها الذرية من 89 وتنتهي عند 103، والعنصر الأول في الأكتينيدات هو الأكتينيوم، ورقمه الذري 89 ورمزه الكيميائي هو Ac. ورثت عائلة الأكتينيدات اسمها من الأكتينيوم، وهذا يعتبر هو تصنيف الاكينيدات عند النظر إلى تصنيف العناصر في الجدول الدوري .
ويوثق الجدول خمسة عشر عنصرًا من عناصر الأكتينيدات، جنبًا إلى جنب مع عددها الذري وكتلتها. يشير العدد الذري إلى عدد البروتونات الموجودة في نواة الذرة. وتحتوي الذرات المشحونة محايدًا على عدد متساوٍ من البروتونات والإلكترونات، الكتلة الذرية هي متوسط كتلة الذرة المقاسة بواسطة وحدة الكتلة الذرية.
تشكيل عناصر الاكتينيدات
جميع الأكتنيدات عناصر لينة هي عوامل معقدة أفضل من اللانثانيدات نظرًا لصغر حجمها ولكن شحنة نووية أعلى. يمكنهم تكوين مجمعات Pπ أيضًا، وتنخفض درجة لون البشرة بالترتيب M4 +> MO22 +> M3 +> MO22 +.
وبسبب طاقة التأين المنخفضة، تكون الأكتينيدات موجبة للكهرباء من اللانثانيدات والأكثر تفاعلية، وتتفاعل مع الماء الساخن. وتتفاعل مع العوامل المؤكسدة وتشكل طبقة سالبة، وتشكيل الهاليدات والهيدرات، كما أن الأكتينيدات عوامل اختزال قوية.
ما هي الخصائص الفيزيائية للأكتينيدات؟
- كثافة الأكتينيدات: جميع الأكتينيدات باستثناء الثوريوم والأمريسيوم لها كثافة عالية جدًا.
- نقاط انصهار وغليان الأكتينيدات: تتمتع الأكتينيدات بنقاط انصهار عالية إلى حد ما مثل اللانثانيدات ولكن لا يوجد اتجاه محدد في درجة انصهار وغليان اللانثانيدات.
- الخصائص المغناطيسية للأكتينيدات: جميع الأكتينيدات ذات طبيعة مغنطيسية، والتي تعتمد على وجود إلكترونات غير مقترنة، ويتم إخماد العزم الزاوي المداري بسبب حماية الإلكترونات 5f بحيث تكون العزم المغناطيسي المرصود أقل من المحسوبة.
- نظائر الأكتينيدات غير مستقرة بشكل عام، و النظائر لها نفس الأعداد الذرية لأن عدد البروتونات في النواة هو نفسه.
- يبدأ العدد الذري للأكتينيدات من 89 وينتهي عند 103.
- تشترك جميع الأكتينيدات في المظهر الجسدي المتماثل إنها مواد صلبة تنبعث منها بريق فضي.
- حالة الأكسدة العامة لمعظم الأكتينيدات هي + 3.
- الأكتينيدات هي عناصر موجبة للكهرباء، وتميل إلى فقدان الإلكترونات لتكوين أنواع موجبة الشحنة. هذا ما يفسر سبب كون حالة الأكسدة موجبة، +3.
- من المعروف أن الأكتينيدات هي مواد صلبة طرية ومطيلة يمكن تقطيعها بسهولة بالسكين. كما أن جميع الاكتنيدات مشعة.
ما هي استخدامات الاكتينيدات؟
بعد الاجابة على جميع الأكتنيدات عناصر لينة، على الرغم من أن المخاطر مرتبطة بالنشاط الإشعاعي للأكتينيدات. إلا أن هناك العديد من التطبيقات المفيدة أيضًا، حيث تستخدم النويدات المشعة في علاج السرطان، والكيمياء التحليلية، وفي الأبحاث الأساسية في دراسة الهياكل والآليات الكيميائية. ويتم استغلال القوة التفجيرية لليورانيوم والبلوتونيوم بشكل جيد في صنع القنابل الذرية، وفي الواقع، كانت القنبلة الذرية المخصبة باليورانيوم التي انفجرت فوق اليابان هي أول قنبلة يورانيوم يتم إطلاقها .
وتستخدم التفاعلات النووية لليورانيوم 235 والبلوتونيوم 239 حاليًا في محطات الطاقة الذرية لتوليد الطاقة الكهربائية. ويعتبر الثوريوم مفيدًا اقتصاديًا لسبب إمكانية إنتاج اليورانيوم -233 الانشطاري من الثوريوم 232 .
ويستخدم البلوتونيوم 238 في عمليات الزرع في جسم الإنسان لتشغيل جهاز تنظيم ضربات القلب. والتي لا تحتاج إلى الاستبدال لمدة 10 سنوات على الأقل، يصدر الكوريوم 244 والبلوتونيوم 238 حرارة عند 2.9 وات و 0.57 وات لكل جرام، على التوالي. ولذلك، يتم استخدام الكوريوم والبلوتونيوم كمصادر للطاقة على القمر لتوفير الطاقة الكهربائية لنقل الرسائل إلى الأرض.
هل جميع الأكتنيدات عناصر لينة؟
الإجابة هي: “خطأ“، والإجابة الصحيحة هي: “جميع الأكتنيدات عناصر مشعة“، انويتها غير مشتقرة، وتتحول إلى عناصر أخرى، ولمزيد من التفاصيل خليكم معنا.
الأكتنيدات
- الأكتنيدات عناصر مشعة؛ أنويتها غير مستقرة، وتتحول إلى عناصر أخرى.
- اليورانيوم والثوريوم، والبروتاكتينيوم هي العناصر الطبيعية الوحيدة من الأكتنيدات التي توجد في القشرة الأرضية.
- ويمتاز اليورانيوم بطول فترة عمر النصـف لـه؛ حيث تبلغ 4.5 مليارات سنة.
- أما بقية عناصر الأكتنيدات فتكون عناصر مصنعة Synthetic elements في المختبرات والمفاعلات النووية.
- وهذه العناصر المصنعة لها استخدامات كثيرة؛ فيستخدم البلوتونيوم مثلًا وقودًا في المفاعلات النووية.
- أما الأميريسيوم فيستخدم في بعض أجهزة الكشف عن الدخان في المباني.
- وأما عنصر الكاليفورنيوم – 252 – فيستخدم في قتل الخلايا السرطانية.
اللانثانيدات
- فلزات لينة يمكن قطعها بالسكين، ولكنها متشابهة.
- حيث يصعب فصلها عندما توجد في خام واحد.
- ولقد اعتقد قديمًا أنها نادرة الوجود.
- إلا أن القشرة الأرضية في الواقع تحوي من السيريوم أكثر من الرصاص.
- فالسيريوم يكـون 50% من سـبيكة الميسش، التي نجدها في حجر الولاعة.
- والتي تحتوي بالإضافة إلى السيريوم على عناصر مثل لانثانيوم ونيوديميوم والحديد.
العناصر الانتقالية الداخلية
- جميع الأكتنيدات عناصر لينة هناك سلسلتان من العناصر الانتقالية الداخلية، تمتد الأولى من السيريوم إلى اللوتيتيوم.
- وتسمى اللانثانيدات Lanthanides أو العناصر الترابية النادرة.
- وذلك لأن الاعتقاد السائد آنذاك أنها قليلة الوجود، وتوجد عادة متحدة مع الأكسجين في القشرة الأرضية.
- أما السلسلة الثانية فتمتد من الثوريوم إلى اللورينسيوم، وتسمى الأكتنيدات
الفلزات
- تسمى المجموعات 3 – 12 العناصر الانتقالية، وجميعها فلزات.
- وإذا تتبعنا هذه الفلزات في الجدول الدوري من اليسار إلى اليمين سنجد أن خصائص هذه العناصر لا يحكمها نمط تغير واضح.
- مقارنة بالتغير الذي يحدث للعناصر الممثلة.
- وتكون معظم العناصر الانتقالية متحدة مع عناصر أخرى على هيئة خامات، وقد يكون بعضها حراً مثل الذهب والفضة.
هل جميع الاكتنيدات عناصر مشعه؟
نعم، جميع الأكتينيدات عناصر مشعة. وذلك لأن الأكتينيدات هي عناصر ذرية لها 89 أو أكثر من البروتونات في نواتها. عندما تحتوي النواة على هذا العدد الكبير من البروتونات، تكون غير مستقرة وتميل إلى إطلاق الإشعاع للتخلص من الطاقة الزائدة.
يتراوح عمر النصف للأكتينيدات من 22 دقيقة إلى 1.6 × 1019 سنة. الأكتينيوم هو أكثر الأكتينيدات استقرارًا، حيث يبلغ عمر النصف له 21.77 عامًا. أما الأكتينيد الأقل استقرارًا هو كاليفورنيوم-252، حيث يبلغ عمر النصف له 2.645 دقيقة فقط. وتستخدم الأكتينيدات في مجموعة متنوعة من التطبيقات، بما في ذلك:
- توليد الطاقة النووية.
- الطب النووي.
- البحوث العلمية.
ومع ذلك، فإن الأكتينيدات يمكن أن تكون أيضًا خطيرة للغاية. وذلك لأن الإشعاع يمكن أن يسبب تلفًا للخلايا وال DNA.
حل جميع الأكتنيدات عناصر لينة صواب خطأ
خطأ، ليس كل الأكتنيدات عناصر لينة. في الواقع، بعض الأكتنيدات، مثل الأكتينيوم والراديوم والبلوتونيوم، هي معادن صلبة. ومع ذلك، فإن معظم الأكتنيدات، مثل البلوتونيوم والكوريوم والأميريسيوم، هي عناصر لينة نسبيًا.
بشكل عام، كلما زادت العدد الذري للأكتينود، زادت ليونة العنصر. وذلك لأن الأكتنيدات ذات الأرقام الذرية العالية لها كثافة إلكترونية أقل من الأكتنيدات ذات الأرقام الذرية المنخفضة. وهذا يعني أن الروابط بين الذرات في الأكتنيدات ذات الأرقام الذرية العالية أضعف، مما يجعلها أكثر ليونة.
ليست جميع الأكتنيدات عناصر لينة. في الواقع، فإن معظم الأكتنيدات هي معادن صلبة إلى حد ما. الأكتينيوم هو العنصر الوحيد في مجموعة الأكتينيدات الذي يعتبر ناعمًا إلى حد ما، حيث يتمتع بصلابة Mohs تبلغ 2.5. أما البقية فهي معادن صلبة، مع صلابة Mohs تتراوح من 4 إلى 7.
تُعزى صلابة الأكتنيدات إلى بنية شبكتها البلورية. جميع الأكتنيدات لها بنية بلورية سداسية مستطيلة، والتي تتميز بخلايا وحدة طويلة ورفيعة. تؤدي هذه البنية إلى أن تكون الأكتنيدات أكثر صلابة من العناصر ذات الهياكل البلورية الأخرى.
قد يهمك