بحث عن قوانين الغازات
مقدمة
يتعامل العديد من العلماء والمهندسين بشكل يومي مع الغازات في أبحاثهم وتطبيقاتهم المختلفة. يعتبر فهم ودراسة قوانين الغازات أمرًا بالغ الأهمية في هذا السياق. فهم كيفية سلوك الغازات في مختلف الظروف والتطبيقات يساعد على تطوير تقنيات ومكونات أكثر كفاءة وسلامة.
مفهوم قوانين الغازات
قوانين الغازات هي مجموعة من القوانين التي تحكم سلوك الغازات وخصائصها في ظل مختلف الظروف. تعتمد هذه القوانين على المبادئ الفيزيائية والكيميائية التي تنظم تفاعل الجزيئات والضغط والحجم ودرجة حرارة الغازات.
أهمية دراسة قوانين الغازات
دراسة قوانين الغازات ضرورية للعديد من الأسباب. تساعد في:
1.فهم سلوك الغازات: قوانين الغازات تساعد في فهم كيف يتفاعل الغاز تحت ظروف مختلفة من حيث الضغط والحجم ودرجة الحرارة. هذا الفهم العميق يمكن العلماء والمهندسين من تطوير تقنيات جديدة ومحسّنة.
2.تصميم التطبيقات الآمنة: فهم قوانين الغازات يساعد على تصميم وتحسين أنظمة الغازات بطريقة آمنة وفعالة. يمكن تجنب الحوادث والمشاكل المحتملة عن طريق الالتزام بقوانين ومعايير الغازات.
3.<ب>تطبيقات المنتجات: معرفة قوانين الغازات تساعد على تطوير منتجات وتقنيات تعتمد على الغازات مثل أجهزة الاستشعار وأجهزة التحكم بالمناخ وأنظمة الاحتراق المتطورة.
تعريفات أساسية
تعريف الغازات
في علم الفيزياء والكيمياء، تُعرف الغازات على أنها حالة من حالات المادة التي تأخذ شكلها وحجمها القابلين للتغيير بالتأثير الخارجي. تتألف الغازات من جزيئات صغيرة تتحرك بشكل سريع وعشوائي في جميع الاتجاهات. لها خصائص مميزة مثل قابلية الانضغاط والتوسع بالحرارة وقابلية الاختلاط مع بعضها البعض بسهولة.
تعريف الضغط والحجم والحرارة
يعتبر الضغط والحجم والحرارة من المفاهيم الأساسية في علم الغازات.
- الضغط: يشير إلى قوة التأثير الخارجي المؤثرة على وحدة المساحة. وحدة قياس الضغط هي الباسكال (Pa)، ويتم قياسها بواسطة الآلات المسماة البارومترات.
- الحجم: يمثل الحجم المساحة الفعلية التي يحتلها الغاز. يتم قياس الحجم بواسطة وحدات مثل المتر المكعب (m³) أو اللتر (L).
- الحرارة: تشير إلى مقدار الطاقة الحرارية الموجودة في الغاز. يتأثر الحجم والضغط للغاز بالتغيرات في درجة الحرارة.
باستخدام القوانين الفيزيائية المحددة للغازات، يمكننا دراسة سلوك الغازات وتوقع تأثيرات التغييرات في الضغط والحجم والحرارة عليها.
قانون بويل
مفهوم قانون بويل
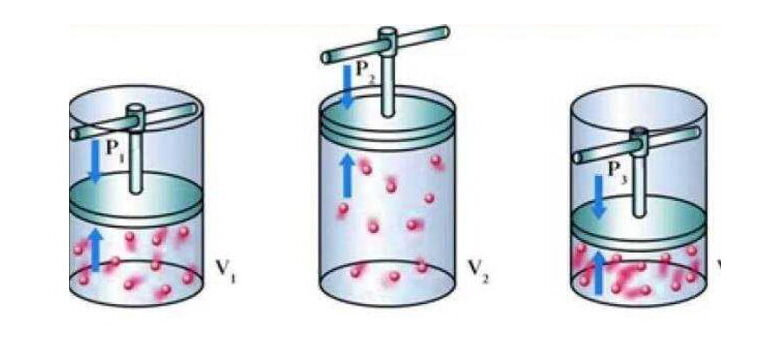
قانون بويل هو أحد قوانين الغازات الأساسية في علم الفيزياء. يُعرف هذا القانون على أنه العلاقة العكسية بين الضغط والحجم عند ثبات درجة الحرارة لكمية معينة من الغاز. بمعنى آخر، كلما ارتفع الضغط على الغاز، قل حجمه، وعلى العكس، كلما انخفض الضغط، زاد حجم الغاز.
علاقة بين الضغط والحجم عند ثبات درجة الحرارة
إذا تم الحفاظ على درجة حرارة الغاز ثابتة، فإن تأثير تغير الضغط يظهر على الحجم. وتُمثل هذه العلاقة بواسطة قانون بويل والذي يقول: “حجم كمية من الغاز يتناسب عكسياً مع الضغط المؤثر عليه عند درجة حرارة ثابتة”، أو بالمعادلة الرياضية PV = مستقل حراري.
هذا يعني أنه كلما زاد الضغط على الغاز، قل حجمه والعكس صحيح، سواءً كان الغاز ثابتًا في حجمه أو كمية المادة.
هذا القانون يتطبق على معظم الغازات المثالية، ويعتبر أساسيًا في فهم السلوك الحراري والضغطي للغازات.
قانون تشارلز
قانون تشارلز هو قاعدة في الفيزياء تصف العلاقة بين حجم الغاز ودرجة حرارته عند ثبات الضغط الخارجي. يُعرف هذا القانون أيضًا باسم “قانون خاطف الحرارة” وهو أحد قوانين الغازات الأساسية.
مفهوم قانون تشارلز
ينص قانون تشارلز على أن حجم الغاز يتناسب طرديًا مع درجة حرارته المطلقة عند ثبات الضغط. يعني ذلك أنه إذا ارتفعت درجة الحرارة المطلقة للغاز، سيزداد حجمه، وإذا انخفضت درجة الحرارة المطلقة، سينقص حجمه. هذه العلاقة تحدد معامل التمدد الحراري للغازات.
علاقة بين الحجم ودرجة الحرارة عند ثبات الضغط
عندما يُحافظ الغاز على ضغط ثابت، فإن تغيير درجة الحرارة سيؤدي إلى تغير في حجمه وفقًا لقانون تشارلز. وتتمثل هذه العلاقة في المعادلة التالية:
V₁ / T₁ = V₂ / T₂
حيث V₁ و T₁ هما حجم ودرجة حرارة الغاز في الحالة الأولى، و V₂ و T₂ هما حجم ودرجة حرارة الغاز في الحالة الثانية.
باستخدام هذا القانون، يمكن توقع تغيرات حجم الغاز عند تغير درجة حرارته في ضغط ثابت. يُستخدم قانون تشارلز في العديد من التطبيقات العملية، مثل تصميم أنظمة التكييف والتبريد وتحليل سلوك الغازات في العمليات الصناعية، وغيرها.
قانون غاي-لوساك
مفهوم قانون غاي-لوساك
قانون غاي-لوساك هو قانون في الكيمياء الفيزيائية يصف العلاقة بين الضغط ودرجة الحرارة عند ثبات الحجم. يقول القانون إنه إذا تم زيادة الضغط بثبات الحجم فإن درجة الحرارة ستزيد أيضًا والعكس صحيح، إذا تم تخفيض الضغط بثبات الحجم فإن درجة الحرارة ستنخفض. يتم استخدام قانون غاي-لوساك في العديد من التطبيقات العملية مثل صناعة الغاز والتهوية وتصميم أنظمة التبريد.
علاقة بين الضغط ودرجة الحرارة عند ثبات الحجم
واحدة من العلاقات الأساسية في قانون غاي-لوساك تقول إن الضغط ودرجة الحرارة عند ثبات الحجم تتناسب طرديًا. هذا يعني أنه كلما زاد الضغط، زادت درجة الحرارة وكلما انخفض الضغط، انخفضت درجة الحرارة. يشير ذلك إلى أن هناك علاقة مباشرة بين الضغط ودرجة الحرارة عند ثبات الحجم.
لذلك، فهم قانون غاي-لوساك يمكن أن يكون ذو أهمية بالغة لفهم العديد من العمليات الكيميائية والفيزيائية التي تحدث في حياتنا اليومية وفي الصناعات المختلفة.
استنتاجات
بعد تحليل قوانين الغازات في العلوم الطبيعية, يمكن القول بأنها تلعب دورًا حيويًا في فهمنا للعالم الطبيعي ومجموعة واسعة من التطبيقات العملية. تمكننا قوانين الغازات من فهم السلوك الذي يمكن توقعه من الغازات في ظروف مختلفة وتساعدنا أيضًا على فهم كيفية تفاعل الغازات مع بيئتها.
أهمية قوانين الغازات في العلوم الطبيعية
تسمح لنا قوانين الغازات بفهم الخصائص الفيزيائية والكيميائية للغازات، وتحليل سلوك الغازات في ظروف مختلفة مثل الضغط والحجم والحرارة. تعتبر هذه المعرفة أساسية في العديد من المجالات العلمية والتقنية مثل الكيمياء والطب والهندسة.
تأثير قوانين الغازات على التكنولوجيا والصناعة
تمتد تطبيقات قوانين الغازات إلى مجالات عديدة في التكنولوجيا والصناعة. فهي تستخدم في صناعة الطيران والسيارات، وتصميم وتشغيل أجهزة التبريد والتكييف، وحتى في صناعة الإلكترونيات والتصنيع الدقيق. فهم قوانين الغازات يمكن أن يسهم في تطوير تكنولوجيا جديدة وتحسين العمليات الصناعية.
الأسئلة الشائعة
أسئلة شائعة حول قوانين الغازات
يعد الامتثال لقوانين الغازات أمرًا هامًا للغاية لأي منشأة أو عمل تتعامل مع الغازات. قد تكون لديك بعض الأسئلة حول هذه القوانين والتزاماتك تجاهها. فيما يلي بعض الأسئلة الشائعة حول قوانين الغازات:
- ما هي قوانين الغازات؟
- هل يلزم الامتثال لقوانين الغازات في جميع الصناعات؟
- ما العواقب القانونية لعدم الامتثال لقوانين الغازات؟
- كيف يمكنني التأكد من أني ألتزم بقوانين الغازات بشكل صحيح؟
- هل هناك معايير خاصة بنوع معين من الغازات؟
إجابات عن الأسئلة الشائعة حول قوانين الغازات
- قوانين الغازات هي التشريعات واللوائح التي تضعها الحكومات للحماية من مخاطر الغازات الخطرة وضمان السلامة العامة.
- نعم، يجب الامتثال لقوانين الغازات في جميع الصناعات التي تتعامل مع الغازات الخطرة.
- العواقب القانونية لعدم الامتثال لقوانين الغازات تشمل الغرامات المالية والمسؤولية القانونية.
- للتأكد من الامتثال بشكل صحيح لقوانين الغازات، يجب عليك الاطلاع على التشريعات المعمول بها في منطقتك والالتزام بجميع المتطلبات المحددة.
- نعم، هناك معايير خاصة بكل نوع من الغازات يجب الالتزام بها. يرجى الرجوع إلى التشريعات المحددة لمزيد من التفاصيل.





