يسمى الماء في المحلول المائي.. الجزيء. الراسب. المذاب. المذيب. يصدأ القضيب من الحديد بمعدل أسرع بكثير من برادة الحديد رغم تماثلهما في الكتلة .
جدول المحتويات
مفهوم المحلول المائي
مقدمة عن مفهوم المحلول المائي
تعد الماء أحد الموارد الأكثر أهمية في الحياة. وفي الكيمياء، يعرف المحلول المائي بأنه مزيج يتكون من الجزيئات المذابة والمذيب المائي. يعتبر المحلول المائي أحد أشكال التفاعلات الكيميائية الشائعة والمهمة في العديد من الصناعات والعمليات الكيميائية.
تعريف الجزيء في المحلول المائي
تشير مفاهيم الجزيء والراسب والمذاب والمذيب في المحلول المائي إلى العناصر المختلفة الموجودة في هذا المزيج الكيميائي. الجزيء هو الكيان الفردي الذي يتحد مع المذيب لتشكيل المحلول المائي. بعبارة أخرى، هو الجزء غير المذاب من المادة الموجودة في المحلول.
تأثيرات الجزيء على صفات المحلول المائي
تؤثر الجزيئات الموجودة في المحلول المائي على خصائصه بشكل كبير. فعندما تنحل الجزيئات في الماء، يتم تغيير بعض الصفات الفيزيائية والكيميائية للمحلول. على سبيل المثال، يمكن أن تؤثر الجزيئات المذابة على درجة الحرارة والقوة السطحية واللزوجة والتوصيل الكهربائي للمحلول المائي.
في الختام، يمكن القول أن المحلول المائي أمر ضروري في الكيمياء والصناعات الأخرى. فهو يمثل واحدة من أشهر أشكال التفاعلات الكيميائية، ويتكون من الجزيئات المذابة والمذيب المائي. يؤثر الجزيء على صفات المحلول المائي ويمكن أن يكون له تأثيرات ملحوظة على الخصائص الفيزيائية والكيميائية للمحلول.
عناصر المحلول المائي
في علم الكيمياء والعلوم الطبيعية، يعد الماء مذيبًا ممتازًا وأكثر طبيعية حيث يمتلك القدرة على حل مجموعة واسعة من المواد الكيميائية. ولفهم عناصر المحلول المائي، يجب معرفة مفهوم الراسب، المذاب، والمذيب.
الراسب في المحلول المائي
عندما يتجمع مادة صلبة في المحلول المائي وتترسب على قاع الحاوية، فإنها تعتبر راسبًا. غالبًا ما ينتج الراسب عندما تصل نسبة المادة المذابة في الماء إلى نقطة التشبع، حيث لا يستطيع الماء حمل المزيد من المادة المذابة.
المذاب في المحلول المائي
المذاب هو المادة المتواجدة في المحلول المائي التي يتم حلها في الماء. عندما يتم إذابة المادة في الماء، فإن الجزيئات الصلبة أو السائلة تتفتت وتتشتت في الماء حتى تصبح جزيئات متناهية الصغر.
المذيب في المحلول المائي
الماء هو المذيب الرئيسي في المحلول المائي. إن قدرته العالية على حل المواد الأخرى تجعله متعدد الاستخدامات في العديد من التطبيقات والصناعات. ويمكن أن يكون المذيب في المحلول المائي أيضًا غازًا أو سائلاً غير الماء، على الرغم من أن الماء هو أكثر المذيبات استخدامًا.
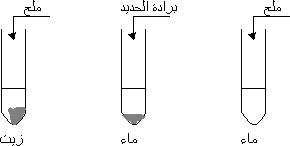
وبالمقارنة بين الحديد النقي والماء، يصدأ الحديد بمعدل أسرع بكثير من برادة الحديد على الرغم من أنهما يتمتعان بنفس الكتلة. هذا يعود إلى احتواء الماء على الأوكسجين التي تسهم في التفاعل الكيميائي للتأكسد وتكوين الصدأ. يعني ذلك أن برادة الحديد تحمي الحديد من التأكسد في حين أن الماء يشجع على تكون الصدأ.
تأثير الحديد في المحلول المائي
عندما يتعلق الأمر بالماء وتجارب الكيمياء المنزلية، ليس من الغريب أن نلاحظ تأثير الحديد في المحلول المائي.
تفاعل القضيب من الحديد في الماء
عند وضع قضيب من الحديد في الماء، يبدأ تفاعل يؤدي إلى تشكيل صدأ على سطح القضيب. يعود ذلك إلى انتقال الإلكترونات من الحديد إلى الماء، مما يكون سبباً في تآكل الحديد وتكوين الصدأ. يعتبر هذا تفاعلًا كيميائيًا يحدث عندما يتعامل الحديد مع الأكسجين والماء في الهواء.
مقارنة بين معدل إصدار الصدأ من القضيب وبرادة الحديد
لاحظ العديد من الأشخاص أن الصدأ يتشكل على القضيب من الحديد بمعدل أسرع بكثير من برادة الحديد، على الرغم من أن كلاهما لديه نفس الكتلة. يعود ذلك إلى الفروق في الشكل والتعرض للهواء والرطوبة. قضيب الحديد يكون أكثر حساسية للأكسجين والماء وعناصر أخرى يحتويها الماء، مما يؤدي إلى انطلاق الصدأ بمعدل أسرع.
أسباب تفاوت سرعة إصدار الصدأ في القضيب وبرادة الحديد
تعتبر عوامل عديدة تسهم في تفاوت سرعة إصدار الصدأ بين القضيب من الحديد وبرادة الحديد، وتشمل ما يلي:
- شكل الأجزاء: قضيب الحديد يتعرض لمساحة أكبر من الهواء والماء مما يتسبب في تفاعل أسرع.
- التعرض للرطوبة: قضيب الحديد عادة ما يكون أكثر تعرضًا للرطوبة مما يؤدي إلى زيادة تكون الصدأ.
- الاختلاف في المواد المكونة للماء: قد يحتوي الماء الذي يتعامل معه الحديد على ملوثات أو مواد كيميائية قد تزيد من سرعة تآكل الحديد.
باختصار، يمكن أن يصدأ القضيب من الحديد بمعدل أسرع بكثير من برادة الحديد نظرًا لعدة عوامل، مثل شكل الأجزاء والتعرض للرطوبة ومكونات الماء المتغيرة.
النتائج والاستنتاجات
تحليل مقارنة بين المحلول المائي والقضيب من الحديد
عند تعريض الحديد للماء لفترة طويلة، فإنه يتفاعل مع الأكسجين في الهواء ويتكون الصدأ. ومع ذلك، يمكن للماء أن يكون أيضًا مذيبًا للعديد من المواد الكيميائية والمركبات الأخرى.
في المحلول المائي، يتم حل المواد الكيميائية في الماء وتصبح جزيئاتها منفصلة ومتناغمة مع جزيئات الماء. يمكن للماء أن يكون مذيبًا فعالًا للعديد من المواد، بما في ذلك الأملاح والمعادن والأحماض والقواعد.
ومع ذلك، عندما يتعلق الأمر بالحديد، تحدث عملية تآكل يمكن أن تنتج عنها تشكيل الصدأ. يرتبط ذلك بتفاعل الحديد مع الماء والأكسجين، حيث يحدث تأكسد الحديد ويتشكل الهيدروكسيدات والأكسيدات.
هنا بعض النقاط الرئيسية التي يمكن التوصل إليها من هذه التحليل المقارن:
- الماء يمكن أن يكون مذيبًا للعديد من المواد الكيميائية والمركبات، بما في ذلك الأملاح والمعادن والأحماض والقواعد.
- عملية تآكل الحديد تحدث عند تعريضه للماء والأكسجين، حيث يتشكل الصدأ.
- تتعلق سرعة تآكل الحديد بخصائص المحلول المائي، مثل معدل التدفق والتركيزات المائية والمواد الكيميائية الأخرى الموجودة.
- قد يحدث تآكل الحديد بسرعة أكبر في المحلول المائي بسبب وجود مواد كيميائية أخرى مذيبة.
الأسئلة المتكررة
- هل يسبب الماء تآكل الحديد؟
- نعم، تعرض الحديد للماء والأكسجين يمكن أن يؤدي إلى تشكيل الصدأ.
- هل الماء يمكن أن يذيب العديد من المواد الكيميائية؟
- نعم، الماء يمكن أن يكون مذيبًا فعالًا للعديد من المركبات المختلفة مثل الأملاح والمعادن والأحماض والقواعد.
- ما هي عوامل تآكل الحديد في المحلول المائي؟
- تتعلق سرعة تآكل الحديد بخصائص المحلول المائي مثل معدل التدفق والتركيزات المائية والمواد الكيميائية الأخرى الموجودة.
- هل يمكن للحديد أن يتفاعل مع مواد أخرى في المحلول المائي؟
- نعم، الحديد يمكن أن يتفاعل مع العديد من المواد الكيميائية الأخرى في المحلول المائي ويتشكل الصدأ.